Результаты 1 этапа 1 фазы клинических исследований
06 июня 2024 г.
Составлен предварительный отчёт о результатах 1 этапа 1 фазы клинических исследований
Краткие результаты 1 этапа 1 фазы клинических исследований:
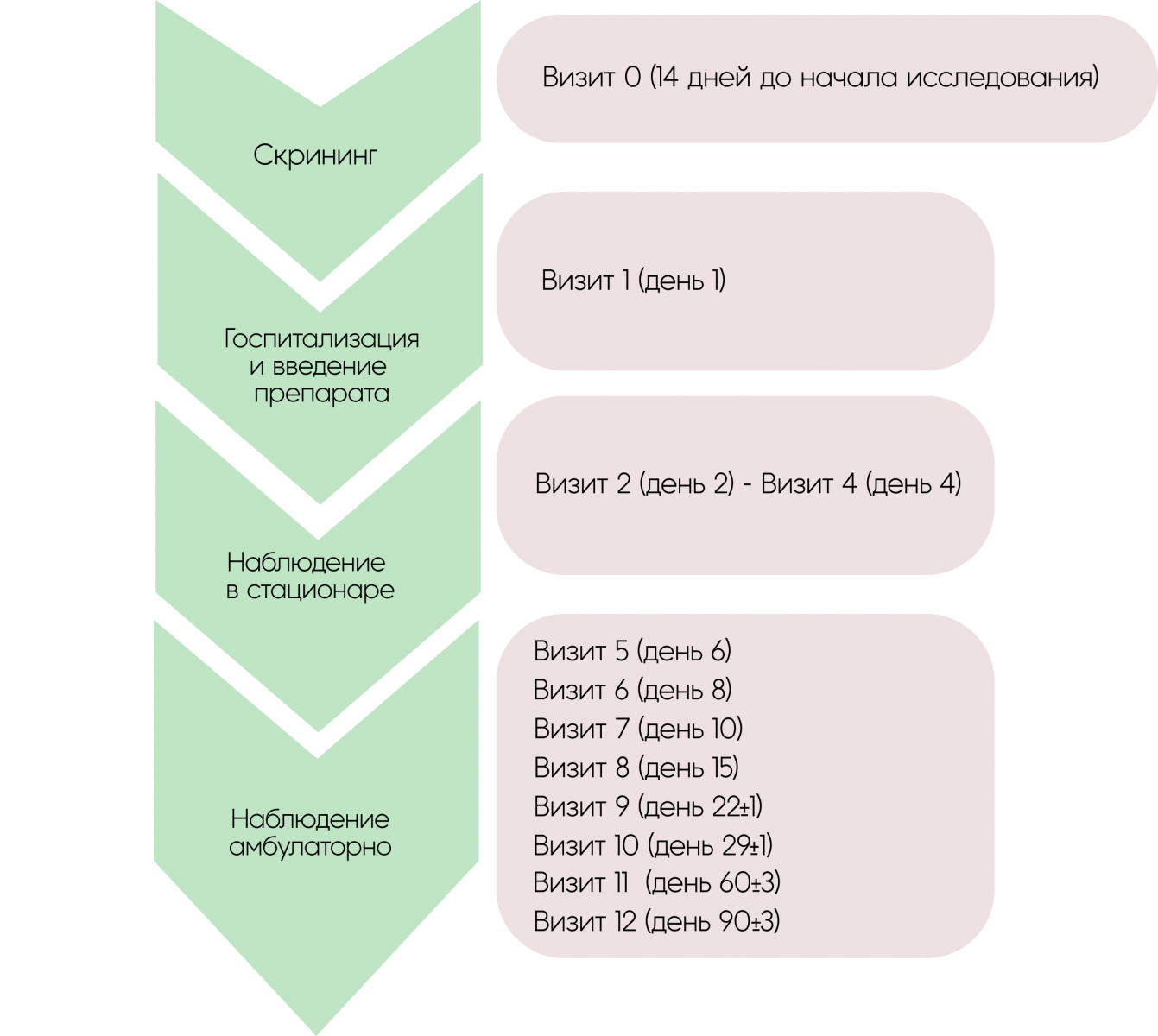
Всего препарат однократно был введён 19 пациенткам в дозах от 107 до 108 БОЕ на пациентку.
Явлений дозолимитирующей токсичности не было зарегистрировано.
Заключение об эффективности:
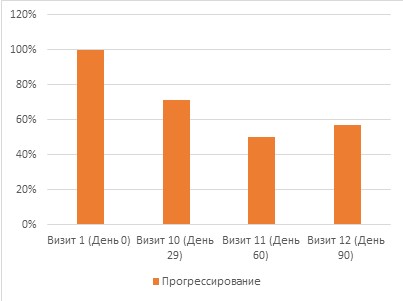
Категориальный параметр эффективности (Объективный ответ на лечение по шкале RECIST 1.1):
- Визит 10 (День 29): в целом было обследовано 14 пациенток, у 4 (28,57) отмечена стабилизация, у 10 (71,43) – прогрессирование заболевания.
- Визит 11 (День 60): в целом было обследовано 8 пациенток, у 4 (50,00) отмечена стабилизация, у 4 (50,00) – прогрессирование заболевания.
- Визит 12 (День 90): в целом было обследовано 7 пациенток, у 3 (42,86) отмечена стабилизация, у 4 (57,14) – прогрессирование заболевания.
Рис.2 Объективный ответ на лечение по шкале RECIST 1.1
(Response Evaluation Criteria In Solid Tumors) - критерии оценки ответа солидных опухолей
Количественный параметр эффективности (Размер измеряемых опухолевых очагов, мм):
- Скрининг: в целом было обследовано 19 пациенток, средний размер опухолевых очагов составил 100,68±56,92 мм. Визит 10 (День 29): в целом было обследовано 14 пациенток, средний размер опухолевых очагов составил 108,43±62,61 мм. Среднее изменение размера измеряемых опухолевых очагов, нормированное на значение на визите Скрининга, составило 0,21±0,35 мм.
- Визит 11 (День 60): в целом было обследовано 8 пациенток, средний размер опухолевых очагов составил 99,88±41,51 мм. Среднее изменение размера измеряемых опухолевых очагов, нормированное на значение на визите Скрининга, составило 0,15±0,17 мм.
- Визит 12 (День 90): в целом было обследовано 8 пациенток, средний размер опухолевых очагов составил 98,29±40,42 мм. Среднее изменение размера измеряемых опухолевых очагов, нормированное на значение на визите Скрининга, составило 0,12±0,27 мм.
